智能水凝胶递送平台
水凝胶是一种具有优异亲水性、柔韧性和溶胀特性的三维网络立体结构的高分子材料,并且具有良好的生物相容性和可降解性。因此,水凝胶在载药输送、组织支架等生物医学领域有极大的应用潜能。
子时纳米提供纳米凝胶定制服务,根据不同的应用需求以满足特定的效果。

根据不同的外界刺激环境条件,可以把智能水凝胶分为pH响应型水凝胶、温度响应型水凝胶、化学响应型水凝胶和光响应型水凝胶等。不同的外界刺激环境需要水凝胶在分子结构上做出相应设计,从而使水凝胶网络表现出溶胀或降解行为。
1. 智能水凝胶分类:
1.1 pH响应型水凝胶
pH响应型水凝胶是指可以对水溶液pH变化产生响应的水凝胶。众所周知,不同组织部位具有不同的pH,并且组织损伤部位常伴随着pH的改变。因此,pH响应特性赋予了水凝胶可注射性,可将聚合物水溶液注射到病灶组织,通过组织周围pH的变化原位形成凝胶网络结构。
常用于组织工程领域的pH响应型水凝胶通常含有pH响应的共价键,pH的变化将会引起此类共价键的断裂或形成,从而导致水凝胶网络的解离或形成。例如,Grover等开发了一种可在酸性环境催化下形成肟键交联的水凝胶(图1(a))。该水凝胶体系由含有酮和羟胺基团的四臂聚乙二醇(PEG)组成,研究发现可通过调控pH来控制凝胶形成的时间,从而实现原位注射形成水凝胶网络(图1(b))。由于心肌梗死区域为典型的酸性环境,该水凝胶可作为微创递送系统的载体材料,通过导管将水凝胶递送到左心室,在心肌梗死区域形成心肌重塑的水凝胶载体,进行心肌梗死的治疗,实现左心室功能的恢复。
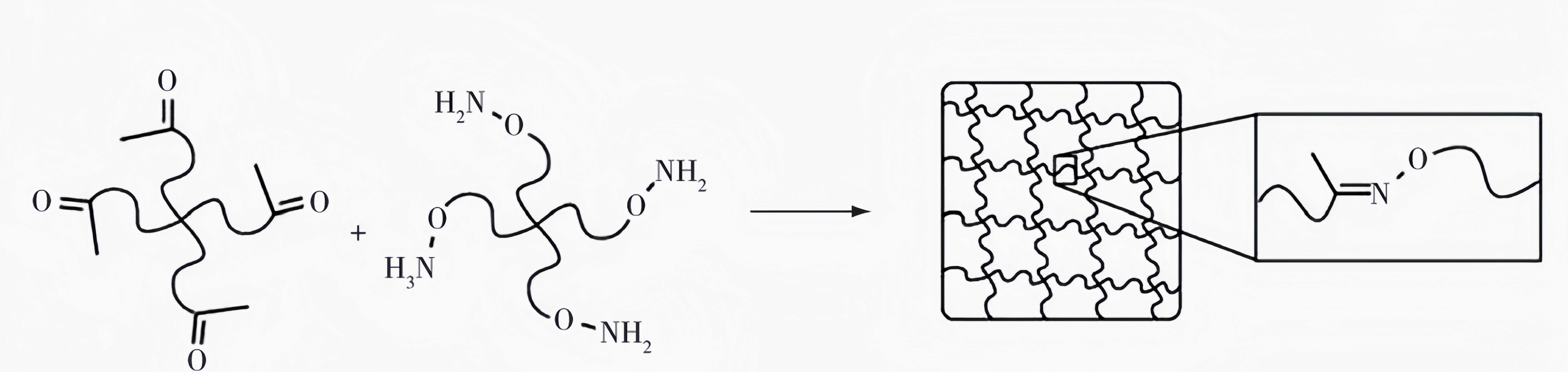
(图1(a)) 肟键交联的PEG水凝胶
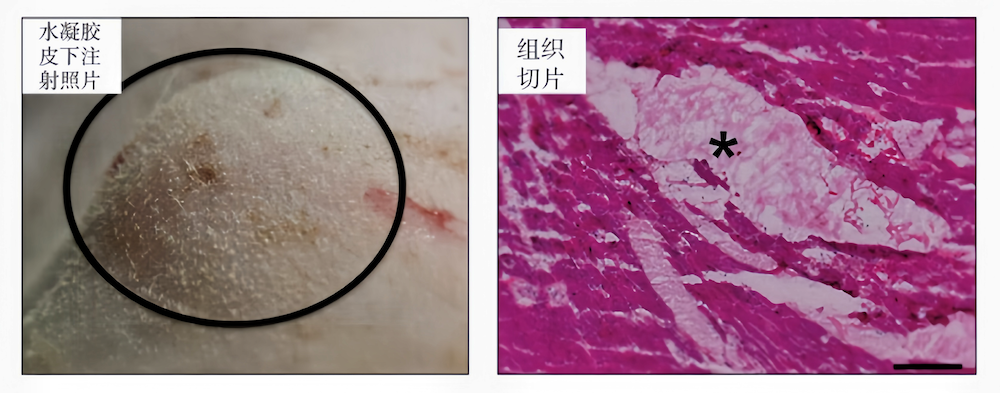
(图1(b)) 水凝胶皮下注射与组织切片 图1 用于导管注射治疗心肌梗死的肟键交联可注射水凝胶
1.2 温度响应型水凝胶
温度响应型水凝胶通常同时具备亲水和疏水基团,具有温度响应的相转变性质,这一温度转变点称为最低临界溶解温度(LCST)或最高临界溶解温度(UCST)。由于人体温度和室温相差较大,因此,相转变温度在人体温度附近的温度响应型水凝胶材料便十分适用于制备组织工程支架。
随温度改变而体积发生溶胀或收缩的水凝胶被称作温度响应型水凝胶。温度响应型水凝胶可根据凝胶体积随温度变化的情况分为两类:第一类为热胀温度响应型水凝胶,该类水凝胶有上临界溶解温度(UCST),在UCST之上,水凝胶是溶胀(溶解)的,而在UCST之下,水凝胶是收缩(不溶)的。第二类为热冷缩温度响应型水凝胶,该水凝胶有下临界溶解温度(LCST),在LCST之上,水凝胶是收缩(不溶)的,而在LCST之下,水凝胶是溶胀(溶解)的。
Cai等制备了一种基于多肽和PNIPAm的双网络水凝胶(SHIELD),SHIELD的结构设计如图2(a)所示,其中组分1为PEG分子共轭连接1个PNIPAm和7个富含脯氨酸的多肽,另一组分则由含有CC43WW多肽结构域和精氨酸甘氨酸天冬氨酸(RGD)序列多肽的线性重组蛋白(C7)组成。SHIELD可以用来直接注射移植干细胞,如人脂肪干细胞(hASCs)。多肽之间的分子识别可形成弱水凝胶网络,在注射过程中提供力学保护,从而降低注射过程中剪切应力引起的细胞损伤;当温度升高至SHIELD的LCST(34℃左右)时,由于PNIPAm聚合物链之间的疏水作用增强,强化了水凝胶网络结构,提高细胞的滞留时间,从而提供细胞增殖分化(图2(b),DAPI为荧光染料)的微环境。
另一类具有LCST的水凝胶为PEG和聚丙二醇(PPG)的共聚物,即PEG-PPG-PEG三嵌段共聚物。该类水凝胶的网络形成依赖于疏水PPG与亲水PEG之间的自组装作用,当温度升高至LCST时,聚合物从溶胶转变为凝胶。并且LCST的高低可以通过PEG和PPG的链段长度来调节,该类聚合物已作为商品(Pluronics系列)得到了广泛使用。但这类水凝胶通常有不耐用、难降解等缺陷,可将PPG链段替代为乳酸羟基乙酸共聚物(PLGA),即制备PLGA-PEG-PLGA水凝胶,进而增强聚合物分子间作用力并提高降解速率。
具有UCST的典型代表为聚丙烯酸(PAA)类、明胶和部分多糖(琼脂糖、直链淀粉和卡拉胶等)水凝胶。在低温下,PAA的分子间氢键增强,使得水凝胶网络收缩;而当温度升高时,氢键部分破坏,水凝胶吸水溶胀。明胶和部分多糖则会在低温下形成三螺旋和双螺旋结构,因此形成物理交联水凝胶,在温度高于UCST时,多肽和多糖则重新溶解于水中。作为胶原的衍生物,明胶不仅可以通过温度来调控力学性能,还具有优异的生物相容性、生物降解性和细胞黏附性,因此,近年来被广泛用于3D生物打印组织工程支架。
Laronda等报道了一种利用明胶水凝胶打印人造生物微孔支架实现小鼠卵巢重建的方法(图3)。作为符合3D生物打印的水凝胶材料往往需要平衡其力学行为,使其同时满足打印和细胞生长的要求,因此,平衡水凝胶力学行为成了3D生物打印的研究难点之一。针对该问题,Laronda等。

图2(a) SHIELD水凝胶
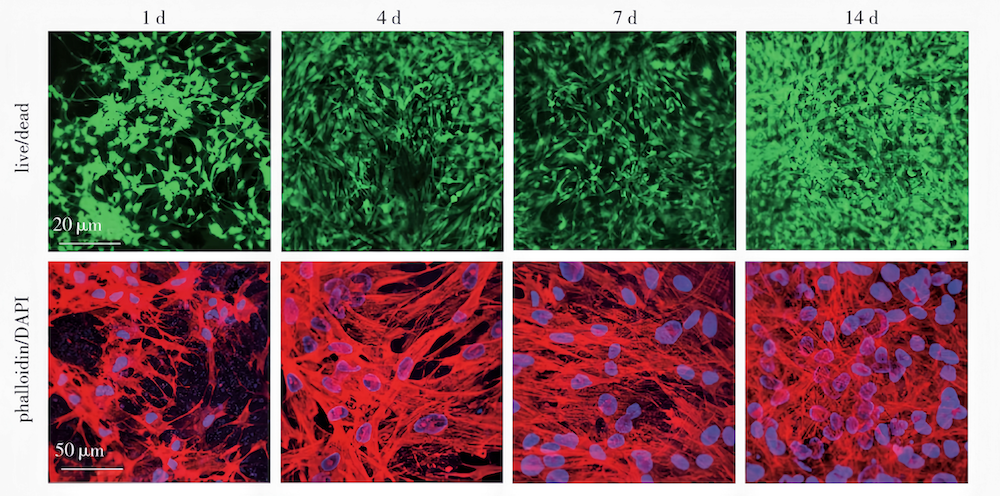
(图2(b) hASCs在SHIELD中培养的共聚焦图像 图2 原位形成的双网络热响应型可注射水凝胶用于提高干细胞移植的滞留
利用明胶在一定温度下(30℃)部分交联的特性(图3(a)),打印出了平滑且连续不断的水凝胶纤丝,并在冷却台上使水凝胶完全交联,精确打印出了适合卵泡生长的复杂微孔支架(图3(b)));将该支架用于培养卵泡,可制备人造生物卵巢并植入小鼠卵巢缺损部位,最终重建小鼠卵巢并恢复其功能。
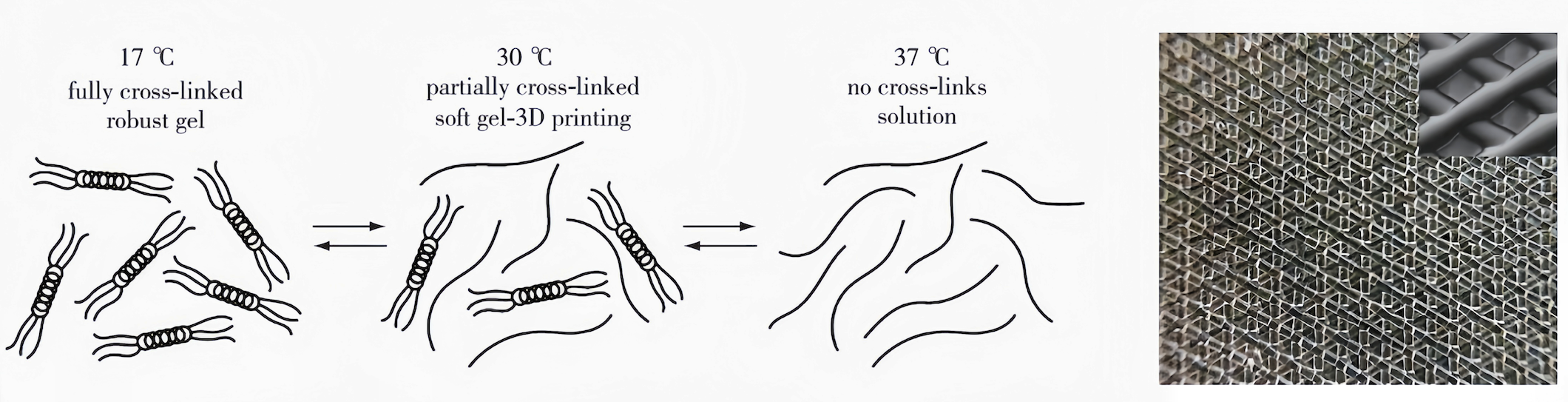
(a) 明胶的热致可逆性质(b)3D打印明胶微孔支架 图3 利用3D打印明胶微孔支架制造的人造生物卵巢恢复小鼠的卵巢功能
1.3 光响应型水凝胶
光响应型水凝胶可在一定波长的光(紫外光、可见光和近红外光等)诱导下形成交联结构或发生降解,分为光交联型水凝胶和光降解型水凝胶。光交联型水凝胶常被用于制备组织工程支架。
常用的光交联型水凝胶材料有PAA、PNIPAm聚乙二醇二丙烯酸酯(PEGDA)、明胶甲基丙烯酸酯(GelMA)、甲基丙烯酸化透明质酸(MeHA)和侧链修饰香豆素分子的聚合物等。
Pi等使用海藻酸钠、甲基丙烯酸酐化明胶(GelMA)和以三季戊醇为核的八臂聚乙二醇丙烯酸酯(PEGOA)复合水凝胶制备生物墨水,装载血管细胞(人脐静脉上皮细胞(HUVECs)、人平滑肌细胞(hSMCs))和尿道细胞(人尿路上皮细胞(HUCs)、人膀胱平滑肌细胞(HBdSMCs)),分别用于打印血管和尿道复层管状组织(图4(a)和4(b))。打印后的水凝胶支架可在海藻酸和Ca2+的物理交联作用下保持稳定形态,进而通过紫外光(UV)的照射,在GelMA和PEGOA聚合物链之间形成化学交联。通过两步交联法,不仅使得该生物墨水具有可打印性,并且在光交联后可进一步提高管状组织的力学性能。打印完的管状组织用螯合剂乙二胺四乙酸(EDTA)洗去海藻酸水凝胶,从而促进细胞的增殖和迁移。利用该方法,Pi等还成功打印出血管和尿道组织支架,可灌注液体和营养物质,促进装载细胞的生长和增殖(图4(c))。
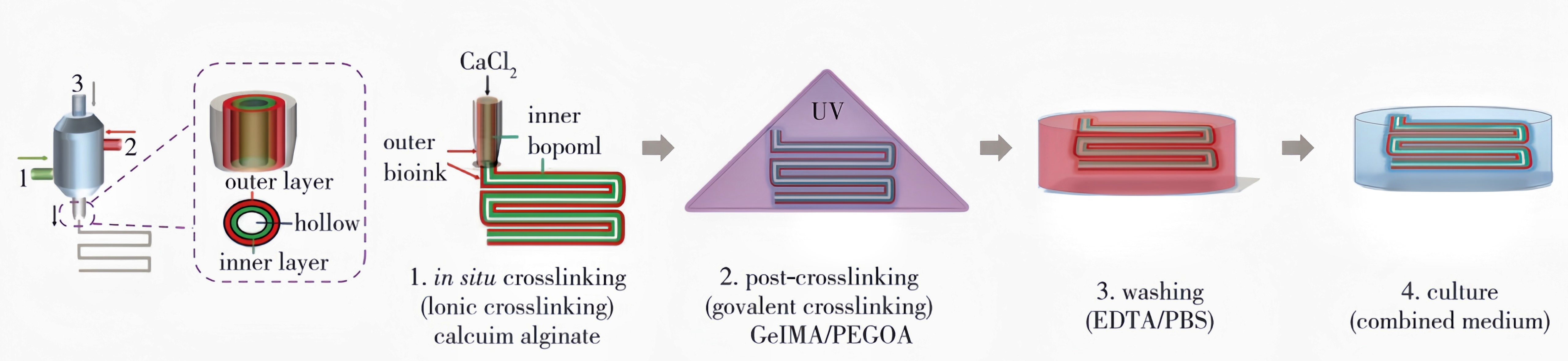
(图4(a))3D生物打印复层中空管

(图4(b))3D生物打印HUCs(内)和HBdsMCs(外)的图像
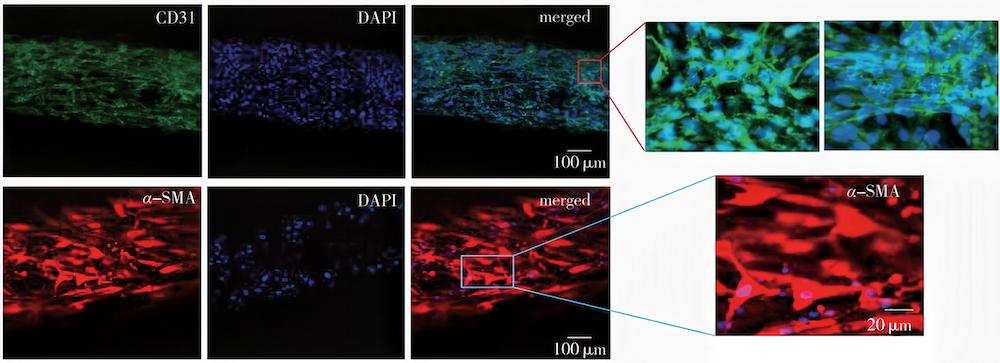
(图4(c))3D生物打印血管的免疫组化染色共聚焦显微镜图像 图4 数字调控的微流体生物打印复层管状组织
1.4 葡萄糖响应型水凝胶
葡萄糖响应型水凝胶可随着环境葡萄糖浓度的改变而改变自身溶胀行为,较常见的葡萄糖响应型水凝胶为葡萄糖氧化酶水凝胶、伴刀豆球蛋白A水凝胶和苯硼酸(PBA)水凝胶。这一特殊响应机制使得葡萄糖响应型水凝胶被广泛用于糖尿病的检测和治疗。
Yesilyurt等设计了一类基于PEG的葡萄糖响应型水凝胶,分别由端基为二元醇和PBA的四臂PEG组成。该水凝胶的交联方式依赖于二元醇与PBA之间的可逆反应,当局部葡萄糖浓度升高时,葡萄糖可取代二元醇而与PBA反应,从而引起水凝胶网络结构的降解,响应释放胰岛素。不仅如此,该水凝胶具有良好的生物相容性,可用作细胞生长支架,在72h的孵育中,细胞可保持较高的存活率,这意味着该水凝胶具有作为组织工程材料的潜力。 组织工程的一大挑战在于形成合适的脉管系统。尽管许多组织工程支架可在足够的营养供给下,对细胞在体外进行较长时间的培养。然而对于生物体内的组织而言,血管是细胞营养和O2供给的主要来源,人造组织植入生物体内后,毛细血管浸润并形成较为完善的血管往往需要几周的时间,人造组织中心部位的细胞便容易因为缺乏足够的养分和O2而凋亡。因此,在植入体内建立脉管系统有助于提高组织工程的成功率。
1.5 酶响应型水凝胶
酶响应型水凝胶的结构中一般含有酶响应型多肽,可响应特定的酶而做出构型改变或结构断裂的行为,从而促进水凝胶网络结构的形成或降解。酶响应型水凝胶在设计层面上往往利用生物体内天然存在或病灶部位异常高表达的酶,例如基质金属蛋白酶(MMP)、磷酸酶和酪氨酸酶等。在组织工程领域,酶响应型水凝胶作为细胞和蛋白载体,可通过酶催化引起水凝胶骨架的降解,从而促进细胞生长因子的释放或提供细胞增殖、分化的环境。
Anjum等制备了基于细胞外基质(ECM)糖胺聚糖(GAG)的酶促形成、酶促降解双响应型水凝胶,用于调节细胞生长因子的递送和干细胞分化。利用MMP敏感的谷氨酰胺转氨酶因子XIII(FXIIIa)特异性底物赖氨酸多肽序列(TGMMPLys)功能化硫酸软骨素(CS),可使CS与谷氨酰胺多肽修饰的八臂PEG(8ARM-PEG-Gln)在FXIIIa作用下交联形成水凝胶,细胞黏附多肽作为模型配体(TGRGDLys)可提高水凝胶的细胞黏附能力。水凝胶包封了骨形成蛋白(BMP2)和人骨髓间充质干细胞(BMMSCs)后,BMMSCs可在MMP介导的水凝胶降解中保持细胞活力,实现增殖和迁移,并且释放的BMP2可诱导BMMSCs成骨分化。该CSPEG复合水凝胶体系采用模块化设计,同样适用于其他生物材料的设计,可灵活整合各类组织诱导再生所需的分子工具,模拟细胞外环境特性,进而实现对细胞分化的控制。
1.6 磁响应型水凝胶
磁响应型水凝胶是将磁性纳米颗粒(MNPs)与聚合物水凝胶复合制成无机/有机复合材料,同时具备了水凝胶的诸多优良特性和磁性材料的磁响应特性。磁响应型水凝胶磁性材料和聚合物水凝胶可通过物理掺杂法、接枝法和原位沉积法复合制备磁响应型水凝胶,最常用的磁性材料为Fe3O4。组织工程的一个关键在于提供细胞生长和组织形成的多孔支架,磁响应型水凝胶一方面可通过MNPs与细胞生长因子及其他生物制剂的结合,在外部磁场的作用下稳定细胞生长因子及其他生物制剂,为细胞接种和后续细胞增殖提供营养环境;另一方面,MNPs与交变磁场(AFM)的相互作用可用于改变水凝胶三维网络结构形态,进而对细胞施加机械性刺激,调控细胞的生物学行为使其定向分化,例如Sapir等发现磁铁矿浸染海藻酸水凝胶支架中的主动脉内皮细胞可通过AFM调控分化成早期毛细血管状结构。
文献研究表明磁响应型水凝胶还可用于三维组织培养。许多体外细胞、组织培养系统是在二维基底上进行的,这与细胞在体内的三维微环境截然不同。针对该问题,Souza等开发了基于细胞磁悬浮技术的三维细胞培养系统,由Au纳米颗粒、磁性Fe3O4纳米颗粒和丝状噬菌体组成。通过空间控制磁场,可以操纵细胞的几何形态并实现多细胞共培养(图5),对磁悬浮人胶质母细胞瘤细胞的研究进一步表明基于该系统的磁悬浮细胞培养更能重现体内蛋白的表达。相比传统的细胞培养技术,该方法可能更适用于未来的新药研发、干细胞研究和再生医学等领域。
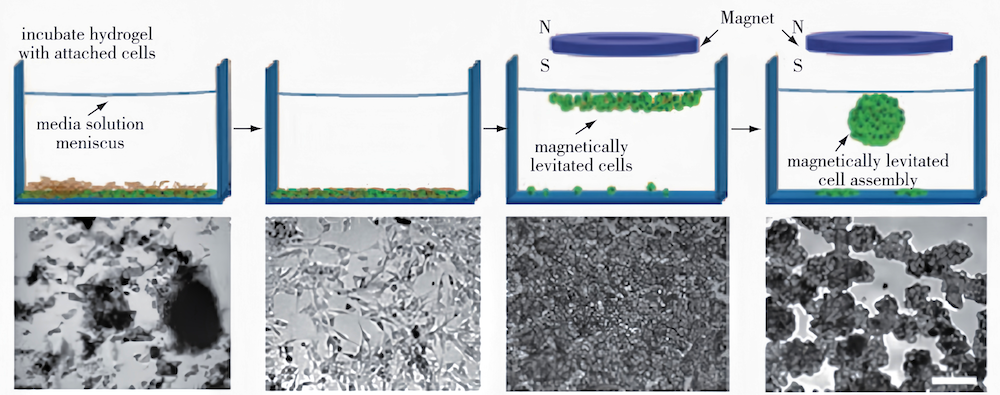
图5 基于细胞磁悬浮的三维细胞培养技术
1.7 氧化还原响应型水凝胶
氧化还原型水凝胶制备过程中使用具有氧化还原性的化合物,如β-环糊精、丙烯酸、柠檬酸、铁离子、双硫腙、联吡啶、氯化血红素等。很多肿瘤部位都有较高水平的谷胱甘肽(GSH),GSH所含巯基使得肿瘤部位呈现还原性的生理环境,有利于氧化还原型水凝胶在此处发挥功效。Hu等用氧化葡聚糖(Odex)、季铵羧甲基壳聚糖(QCCS)和四硫键连接的介孔二氧化硅纳米粒子(4S-MSNs)制备了4S-MSNs水凝胶。4S-MSNs水凝胶通过感受GSH水平而控制药物释放,实现独特的GSH触发药物释放行为。负载阿霉素(DOX)的4S-MSNs水凝胶体外释放结果表明,在10mmo·lL–1GSH浓度水平下,经历192h释药实验后,约有79%的DOX被释放,而在不含GSH的情况下,只有40%的DOX被释放,表明水凝胶具有氧化还原响应性。
2. 智能水凝胶在生物医学领域的应用
2.1 组织工程
组织工程是治疗组织被破坏并且无法修复或功能衰竭的一种有前途且具有挑战性的研究领域,目的是开发一种模拟人体细胞外基质的支架,以支持组织再生。水凝胶由于良好的机械强度、生物相容性、生物降解性以及与人体细胞外基质的相似性而在组织工程中有极大的应用潜力。
Liang等采用简单的一步合成法,用带正电的CS和带负电的卡拉胶(CG)成功构建了均质块状的CS/CG复合水凝胶。该复合水凝胶具有分层的多孔结构和出色的机械性能。CS/CG复合水凝胶的溶胀率可随pH值、盐溶液浓度的变化而变化,表明其具有pH和盐响应性。体外研究表明,CS/CG复合水凝胶提高了ATDC5细胞的活性并促进其增殖。此外,与原始CS水凝胶相比,CS/CG复合水凝胶在体外能够促进ATDC5细胞的软骨分化,并且随着CG含量增加,软骨标志物表达显著增强,表明CG在软骨形成过程中发挥重要作用。因此,CS/CG复合水凝胶应用于关节软骨支架有很大潜力。
2.2 药物载体
很多药物在使用过程中都存在重复给药、免疫应答有限、靶向性差、治疗指数低及不良反应等问题,尤其是在肿瘤药物方面尤为严重,因此寻找缓控释放、无毒的药物载体非常紧要。水凝胶可以与免疫治疗剂、化学抗癌药物、放射性药物、光热剂以及光敏剂等治疗制剂一起装载运输,实现药物控释,延长药物滞留时间,从而成功触发抗肿瘤作用,并维持较长时间。
Wang等将肉桂醛基硫缩醛(CTA)接枝到CS上,制得水凝胶CS-CTA,并将盐酸万古霉素(Van)负载到该水凝胶上制得载药凝胶CS-CTA/Van,研究该凝胶在pH6.0(急性伤口感染部位呈弱酸性)的环境下体外药物释放效果。结果显示,不加H2O2的空白对照组的药物释放量显著低于加H2O2的实验组,表明CS-CTA水凝胶一旦受到活性氧刺激可以促进Van释放。此外,在不同浓度H2O2下,药物累积释放率分别达到71.6%(5mmol·L–1H2O2)和79.3%(50mmol·L–1H2O2)。表明HCS-CTA-G/Van具有优异的活性氧响应性及更好的药物释放效果,显示了作为药物载体和响应材料的优势。
2.3 伤口敷料
传统的敷料虽然吸收性强,对干燥或是轻度渗出的伤口有效,但是传统敷料的黏附性差,定期更换时会对伤口造成二次损伤,这些是现代伤口敷料发展面临的问题。水凝胶具有三维立体网状结构,具有良好的渗透性,优异的生物相容性、黏附性、抗菌性能以及能为伤口提供湿润环境的能力,是制作敷料的理想材料。Jeong等采用N,N′-亚甲基双丙烯酰胺为交联剂,将2-羟丙烯酸乙酯(2-HEA)接枝到羧甲基壳聚糖(CCS)上,制备了CCS-g-pHEA水凝胶药物载体,以诺贝列汀为模型药物,研究其在模拟正常皮肤(pH5.5)和痤疮皮肤(pH7.5)条件下的体外药物释放行为。结果表明,经过24h的体外释放,pH5.5和pH7.5条件下诺贝列汀的累积释放率分别为68.91%和86.51%,CCS-g-pHEA水凝胶药物载体在碱性条件下可提升药物释放量,因此可用作受损皮肤愈合治疗的药物递送系统。使用扩散细胞的体外透皮研究也表明CCS-g-pHEA水凝胶提高了诺贝列汀的透皮能力。因此,CCS-g-pHEA水凝胶有潜力作为一种无毒透皮给药载体,用于治疗皮肤病变。目前市场上已经出现了一些水凝胶伤口敷料,用作伤口治疗,并取得令人满意的效果,例如,康惠尔清创水凝胶和信业生物的喜美痔壳聚糖痔疮生物抗菌水凝胶等。
2.4 传感器
导电水凝胶因具有导电性、可拉伸性、刺激响应性、应变敏感调节的机械性能、生物相容性、自修复、亲水性和易于制备等特性,而成为柔性可穿戴设备研发的良好选择。研究者使用导电水凝胶制作成电子传感器,将应变、温度等转化成电信号,实现对患者生理状况的实时监控和诊疗。
Chen等采用N-羟甲基丙烯酰胺(NMA)和丙烯酸为单体进行共聚反应,制得共聚产物。将共聚产物与蚀刻的Ti3C2TX纳米片通过共价交联和非共价相互作用复合,制备水凝胶NAMH,并测试不同拉伸应变下NAMH的电导率。结果显示在低应变(小于350%)下,NAMH的电导率随着应变的增加而逐渐增加,NAMH在350%应变下的电导率高达5.41s·m–1。当传感器受到外部压力负载时,NAMH传感器闭路中小灯泡的亮度明显增加,能够根据微小的运动输出实时动态信号;在卸载反向压应力后,NAMH快速回弹。表明水凝胶NAMH传感器柔性好、双向应力响应速度快、信号传输灵敏等,在人体运动检测中具有巨大的应用前景。
2.5 3D细胞培养
水凝胶是具有高含水量、多孔聚合的网络,能提供3D细胞培养的环境。这些多孔的结构可以促进氧气、营养物质以及代谢产物扩散。目前已经有天然或合成的水凝胶应用于3D细胞的培养。
王启萌采用席夫碱反应,将氧化透明质酸(oxi-HA)与氨基修饰的明胶(NH2-Gel)制备了oxi-HA/NH2-Gel水凝胶。在酸性条件下,oxi-HA/NH2-Gel水凝胶结构中的亚胺键断裂,oxi-HA/NH2-Gel呈现流动状态;向溶液中加入NaOH将溶液调至碱性后,oxi-HA/NH2-Gel又变为凝胶状态,表明oxi-HA/NH2-Gel水凝胶pH响应性和结构的重建性。水凝胶的状态能够影响细胞扩散、形状、运动和分化。为考察oxi-HA/NH2-Gel水凝胶的细胞培养能力,将3T3细胞三维封装在水凝胶中,发现水凝胶内细胞形态良好,细胞贯穿整个水凝胶生长,有利于细胞生长繁殖。干细胞在水凝胶中的分化试验结果表明,oxi-HA/NH2-Gel水凝胶很好地诱导了干细胞向神经、肌肉和成骨细胞3个方向的分化,说明其在3D细胞培养领域有很大的应用空间。
文章信息源于文献:《智能水凝胶在生物医药领域的应用进展》、《刺激响应型水凝胶用于组织工程的研究进展》,登载该文章目的为更广泛的传递行业信息,不代表赞同其观点或其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若侵犯版权,请联系小编删除。

