脂质体递送平台
脂质体,一种由磷脂双分子层自发形成的封闭小囊泡,脂质结构类似于生物膜,可以包封水溶性和脂溶性药物,具有高度的靶向性、能有效保护被包裹药物并可控释缓释药物,从而显著提高药物治疗指数、降低药物的不良反应,是目前药物输送系统中研究极为广泛的纳米药物载体。
子时纳米提供脂质体定制服务,可以根据您的应用需求,定制相应类型的脂质体,以满足特定的治疗需求。
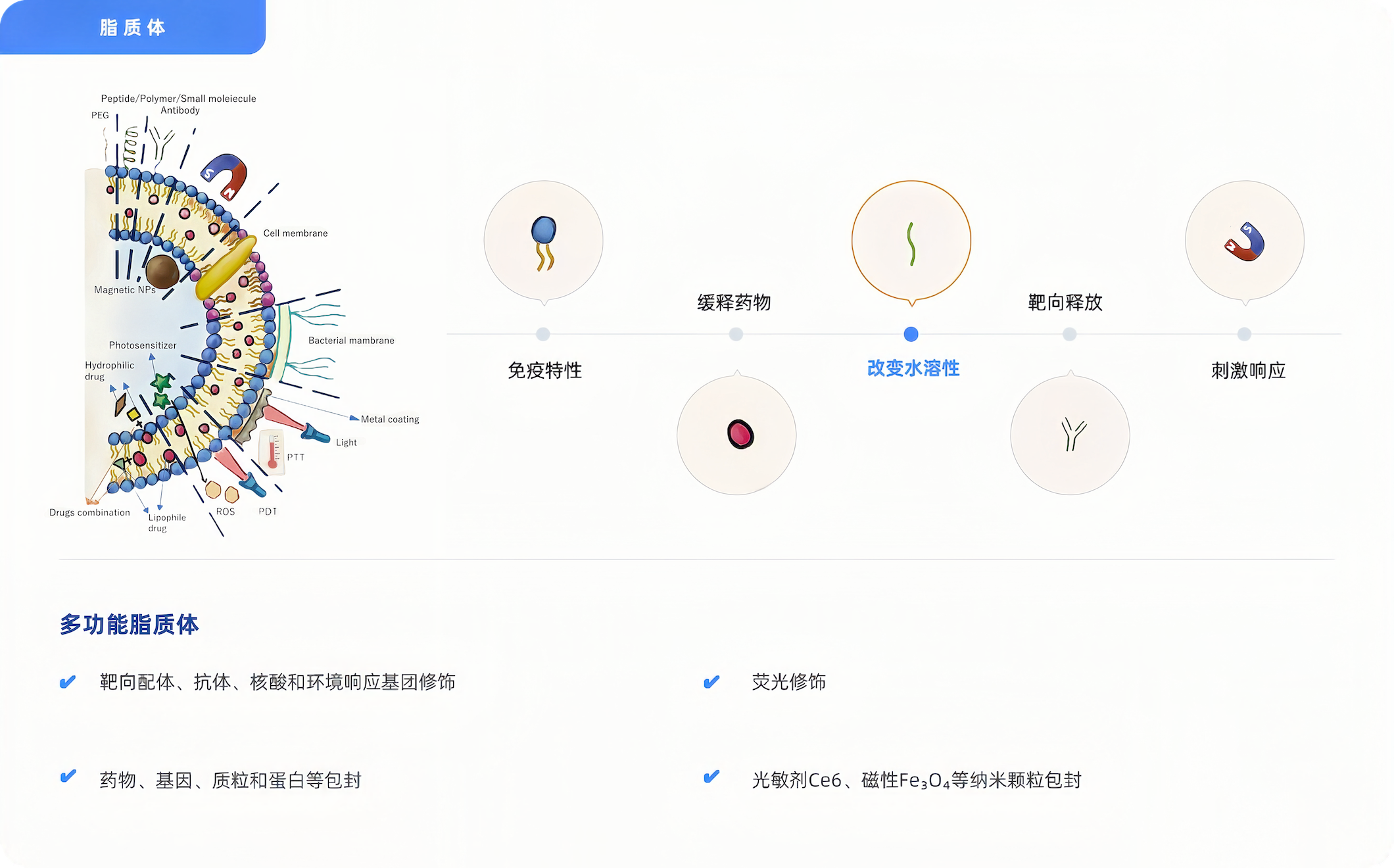
脂质体(liposomes是一种由磷脂双分子层自发形成的封闭小囊泡,脂质结构类似于生物膜,可以包封水溶性和脂溶性药物,具有高度的靶向性、能有效保护被包裹药物并可控释缓释药物,从而显著提高药物治疗指数、降低药物的不良反应,是目前药物输送系统中研究极为广泛的纳米药物载体。
1.第一代脂质体:普通被动靶向、长循环脂质体(隐形脂质体)
脂质体作为药物载体具有很多优点,但是其主动靶向性和稳定性较差。隐形脂质体具有延长脂质体在血液循环中的半衰期、提高其稳定性、改变脂质体在体内的生物学分布,提高有效浓度,从而增强疗效赋予脂质体靶向性的优点。
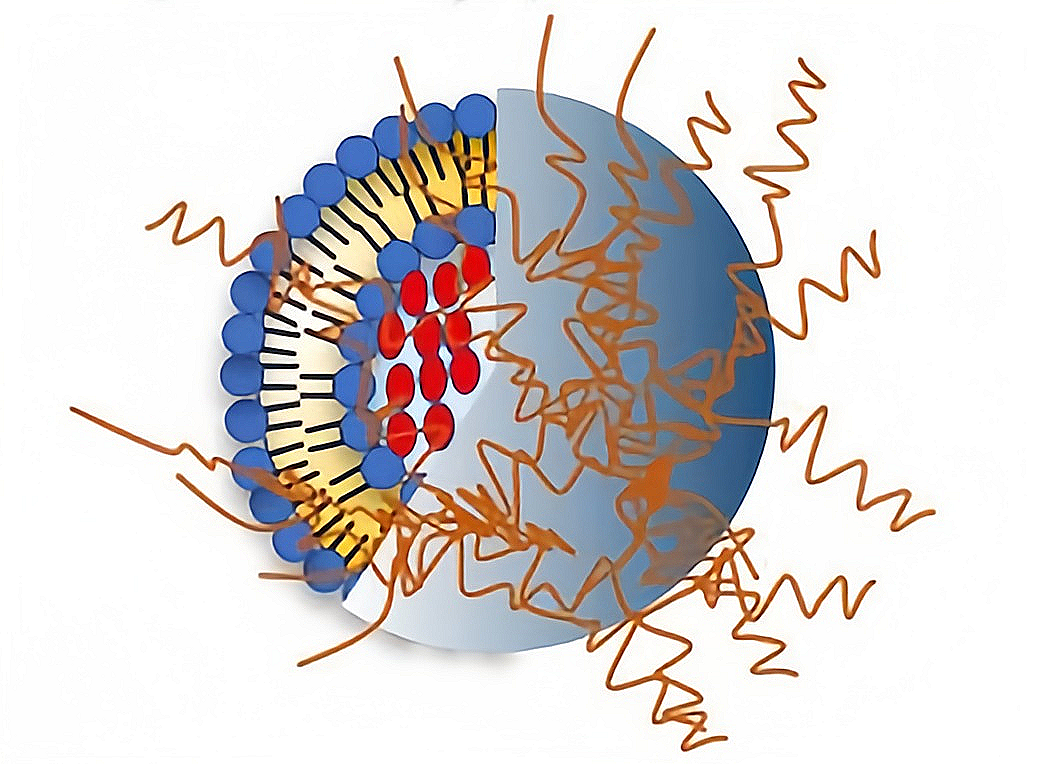
图1 长循环脂质体结构
2.第二代脂质体:主动靶向脂质体
主动靶向脂质体系指利用靶向物质对脂质体进行修饰,使脂质体定向的作用于病灶的一类脂质体。
2.1 受体靶向脂质体
受体靶向脂质体主要是用具有特定受体的配体修饰脂质体,使其靶向性大大增强。常见的受体有叶酸受体、去唾液酸糖蛋白受体、甘草次酸受体、转铁蛋白受体、多肽受体和糖类受体等。
2.1.1 叶酸修饰的靶向脂质体
叶酸(FA)受体(FAR)是细胞有效摄入FA而特异性表达的糖蛋白膜受体,对FA具有高亲和力。当FA与靶细胞上FAR特异性结合时,能通过受体介导的内吞作用被内化进入细胞,研究发现在一些肿瘤细胞表面会高表达FAR,以便摄取更多的FA,这提示FAR可以作为潜在的靶点用于肿瘤靶向治疗。
Nguyen等制备了FA修饰的靶向LPs(FA@AuNR-DOX-LPs)协同化疗和光热疗法治疗乳腺癌。
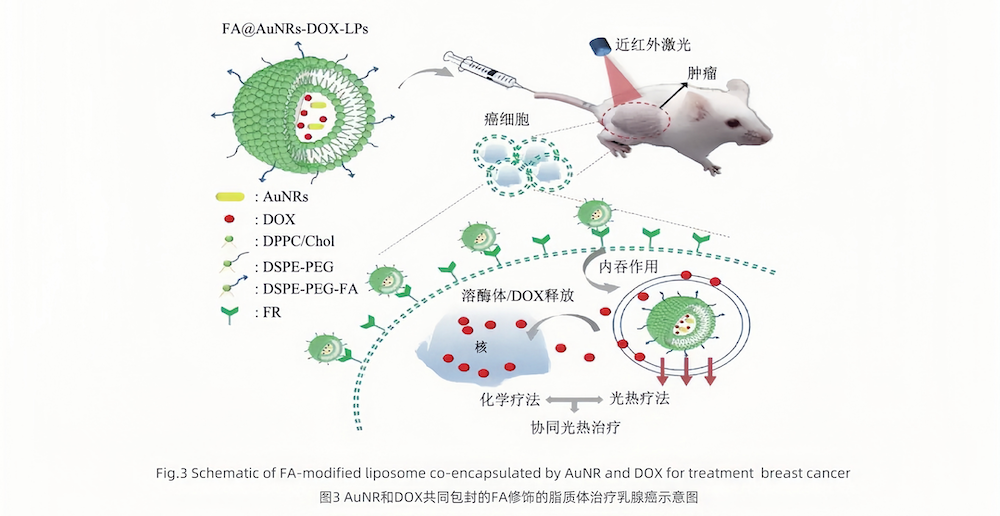
图2 叶酸修饰的靶向脂质体
FA作为靶向修饰物的研究已经受到广泛的关注,因为FAR在多种肿瘤细胞中高表达。许多研究证明,FA可以非常高效地将LPs携带进入肿瘤细胞。
2.1.2 转铁蛋白修饰的靶向脂质体
研究表明,转铁蛋白受体(TFR)在普通细胞和恶性肿瘤细胞中均有表达,但肿瘤细胞的表达率是普通细胞的几倍乃至几十倍,转铁蛋白能够调节铁元素在细胞内的含量,恶性肿瘤细胞对铁的需求量大,所以在细胞表面具有很多的转铁蛋白受体,TFR的单克隆抗体也可直接作用于肿瘤细胞,抑制肿瘤细胞的生长,TFR在肿瘤的基因治疗中也能发挥很好的疗效,能有效提高转染效率。
2.1.3 甘草次酸修饰的靶向脂质体
甘草次酸(GA)是中药甘草中的一种有效成分,具有很好的消炎、抗病毒和抗肿瘤的功效,肝癌的多发位置是肝实质细胞,研究表明肝实质细胞表面有大量的甘草次酸受体,所以用甘草次酸修饰脂质体能够靶向于肝实质细胞,发挥抗肿瘤作用。
2.1.4 多肽修饰的靶向脂质体
多肽分子是机体内一类重要的生物活性物质,参与机体的生长发育以及代谢,同时也是蛋白质水解的中间产物。多肽具有高特异性、高选择性、尺寸小、易修饰和高生物相容性等优点,此外,由于没有三级结构,多肽通常会更加稳定,因此,多肽在靶向给药方面具有非常广阔的应用前景。
常用的靶向肽:肿瘤靶向肽-RGD、cRGD、iRGD(CRGDKGPDC)、LyP-1、APRPG、CREKA、GE11;穿膜肽-CPP、TAT;PH响应穿膜肽-R6H4、R8;脑胶质瘤靶向肽-T7(HAIYPRH)、Angiopep-2;脑靶向肽-RVG29; 肝癌特异靶向肽-SP94等等。
利用多肽修饰LPs将药物输送到癌细胞的研究越来越受关注,体内外的研究也都显示着良好的结果。多肽修饰的LPs可以增加所携带药物在肿瘤细胞中的富集,提高肿瘤治疗的效果,显示出其良好的研究价值和应用前景。
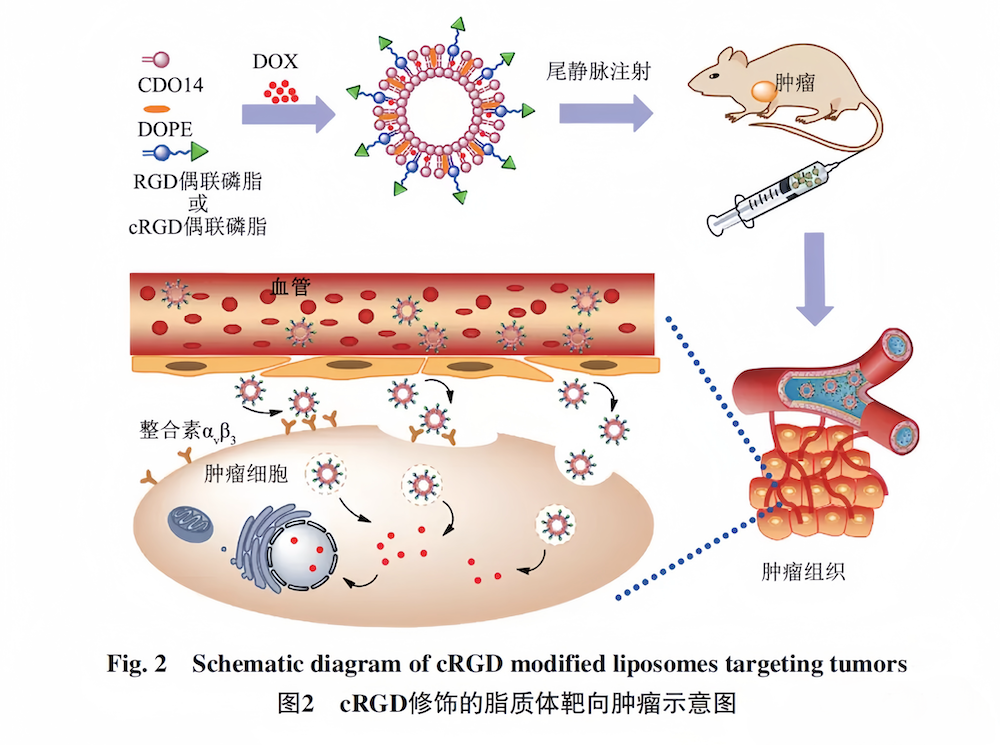
图3 cRGD修饰的脂质体靶向肿瘤示意图
2.1.5 糖基修饰的靶向脂质体
糖类是细胞能量的主要来源,细胞通过糖酵解产生ATP来供给能量。肿瘤细胞相比于正常细胞,需要摄入大量的ATP来维持生存,而细胞膜表面葡萄糖转运体(GLUT)的表达增加可以满足这一要求,GLUT不仅特异性转运葡萄糖,还能转运半乳糖、甘露糖及其衍生物等,同时,糖类还参与细胞的许多代谢过程。此外,基于不同细胞的特点,细胞表面还会特异性表达多种糖受体,将糖基作为配体来修饰LPs,实现靶向肿瘤细胞目的。
2.1.5.1 葡萄糖及其衍生物修饰的脂质体
葡萄糖是细胞能量来源的基本物质,一般细胞表面都会表达GLUT用于摄入葡萄糖,由于肿瘤失去生长控制能力,对于能量的需求极大,这就导致肿瘤细胞表面会过量表达GLUT来维持其能量需求,葡萄糖修饰的LPs就是利用肿瘤细胞表面过表达的GLUT为靶向目标来实现肿瘤细胞的精准靶向药物递送。
2.1.5.2 半乳糖及其衍生物修饰的脂质体
半乳糖(Gal)是广泛存在于奶产品或甜菜中的一种单糖,是某些糖蛋白的重要成分。肝细胞表面存在一类半乳糖受体,也被称为唾液酸糖蛋白受体(ASGPR),可以特异性与Gal结合,以受体介导的胞吞作用大量摄入Gal进行分解代谢和再循环。因此Gal可以作为靶向修饰物,实现药物载体的肝癌细胞靶向。
Gal修饰的LPs展现出了其优异的肝癌细胞靶向能力,通过与ASGPR结合,将LPs以受体介导的胞吞作用摄入细胞。因此,Gal是肝癌细胞靶向载体理想的修饰物。
2.1.5.3 甘露糖及其衍生物修饰的脂质体
甘露糖(Man)是一种单糖,是多种多糖的重要组成成分,在人体代谢过程中,具有重要作用。Man可以与甘露糖受体(MR)结合,用于修饰药物载体进行癌症治疗。MR是一种高效的内源性受体。其功能包括清除内源性分子、促进抗原提呈、调节细胞活化和运输。它在肿瘤转移和免疫逃避中也起着重要作用。
下图例举了以糖类为靶向修饰物的相关信息。利用细胞膜表面的糖受体与糖类物质特异性结合是该修饰的关键。在研究中,需要考虑细胞表面相应糖受体表达的差异性。
| 糖类 | 作用靶点 | 药物 | 性能 |
|---|---|---|---|
| 葡萄糖 | GLUT | PTX | 葡萄糖修饰的LPs能有效穿过BBB,具有高效的脑靶向性能 |
| 4-氨基苯基-D-吡喃葡萄糖苷 | GLUT | 表阿霉素 | 用胶质脑瘤细胞U87-MG在体外模拟BBB,结果表明,修饰后的LPs体外跨BBB转运后显示出较强的药物摄取和抗胶质瘤效果 |
| 正辛基-β-D-吡喃葡萄糖苷 | GLUT | 双氢青蒿素 | 修饰后的LPs粒径小,包封率较高,稳定性好,对人肝癌细胞具有良好靶向性,同时具有抗肿瘤活性 |
| 半乳糖 | ASGPR | 去甲斑鳌素 | Cal修饰的LPs对HepG2细胞的毒作用强于未修饰的LPs和游离的药物,且降低了肾脏毒性 |
| 半乳糖 | GLUT | TADF | 以TADF为荧光探针,评价Gal修饰的LPs靶向肿瘤细胞的能力,结果显示,与空载体相比,Gal修饰的LPs对细胞摄取效率更高 |
| 甘露糖 | MR | PTX | 对比不同MR表达量的细胞,结果显示Man修饰的LPs在MR高表达的细胞具有更高的摄入率 |
2.2 抗体靶向脂质体
抗体修饰的LPs即免疫脂质体(IL),是将单抗或抗体功能化片段插入LPs表面,借助抗体与靶细胞表面抗原特异性结合,从而使LPs递药系统富集于靶细胞,减少药物副作用。
抗体靶向脂质体主要应用的修饰物有单克隆抗体(mab)、Fab’片段(Fab')、单链抗体(scFv)等。单抗比多抗的专一性更好,因而应用更广泛,但单抗是生物大分子,渗透性差,相较于单抗,抗体片段显现出了良好的穿透性,并且抗体片段能够降低单抗的免疫原性,消除率降低。
另一方面,在抗体靶向脂质体表面修饰PEG更有利于提高脂质体的半衰期,但PEG容易遮 挡住抗体结合位点,降低靶向性。有科研工作者介绍了在PEG链末端连接抗体的可行性,制成了空间稳定性免疫脂质体(SIL),下图,明显的弥补了 PEG 掩盖结合位点的不足。
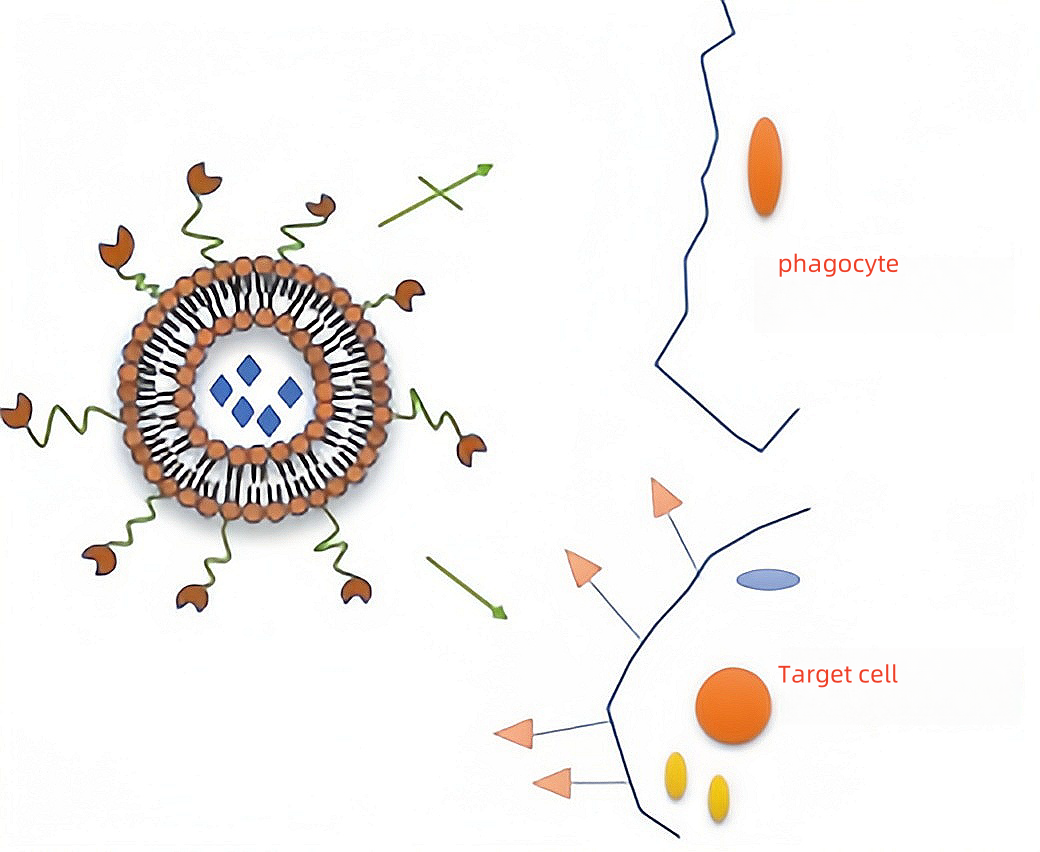
图4 cRGD修饰的脂质体靶向肿瘤示意图
2.3 线粒体靶向脂质体
线粒体是真核生物中一大重要的细胞器,维持细胞正常的生理活动。线粒体病变容易引发细胞癌变,并且肿瘤的转移与线粒体密切相关,所以线粒体是抗肿瘤的一大重要研究项目。恶性肿瘤细胞具有分裂迅速的特点,分裂需要大量的能量, 所以在肿瘤细胞中的线粒体含量比正常细胞多得多,线粒体还控制着肿瘤细胞的凋亡,近年来线粒体作为药物靶向位点的研究也在逐步开展。有研究工作者制备了RGD修饰的线粒体靶向长循环脂质体(RLP-TPP-l 脂质体),证实了采用线粒体作为药物的靶点的一种可能性。TPP具有线粒体趋向性,由于线粒体膜电位与细胞凋亡,采用JC-1染色法检测线粒体膜电位,结果显示经TPP修饰的脂质体能够使线粒体膜电位大幅度降低,且采用RGD修饰增强了这一现象,表明这一药物载体具有明显的靶向作用。
目前主动靶向脂质体的应用多采用双配体、配体-抗体等联合修饰方式,这种方式能够显著提高药物在病理部位聚集,并且增强了药物的治疗指数,具有明显的抗肿瘤优势。
2.4 核酸靶向脂质体
适配体是来源于RNA或 DNA的人工单链和短链寡核苷酸,可通过指数富集的配体系统进化技术制备。这些配体被称为抗体的替代品,其可以较容易地与各种功能基团、生物分子等结合而不失去活性。由于核酸适配体分子量低、非免疫原性好、具有较好的肿瘤穿透性和靶向性,且化学修饰后亲和力不发生变化,因此被更多地用于修饰脂质体发挥靶向作用,应用于肿瘤治疗的药物传递。
3.第三代脂质体:环境响应型的脂质体
3.1 ROS响应性脂质体
癌细胞的ROS浓度(100 μmol/L)大约比正常细胞(20 nmol/L)高2个数量级。ROS响应型脂质体是基于 ROS在肿瘤微环境中高表达的特点而制备。研究者通过化学合成方法在磷脂上键合酮縮硫醇(TK)硫醚、硼酸酯类 、二茂铁等特殊结构对磷脂进行修饰,当制备的脂质体到达肿瘤部位后,在ROS的氧化作用下其脂质膜结构发生变化,实现包载药物的释放。此外,也可在脂质体处方中直接加入适量含不饱和碳碳键的磷脂,如 L-α- 卵磷脂 (Egg PC)、1,2-二-(9Z-十八烯酰基)-sn-甘油-3-磷酸胆碱 (DOPC)、1,2-二亚油酰基-sn-甘油-3-磷酸胆碱(18:2 (Cis) PC)等,不饱和碳碳键可与ROS发生反应引发脂质膜结构的改变,达到释放药物的目的。
3.2 pH敏感型脂质体
在人体正常组织和血液中,细胞外pH值通常维持在7.4,但在肿瘤组织中,由于肿瘤细胞旺盛的糖酵解能力,细胞外pH值通常是酸性的,范围在6.7-7.2 之间。pH敏感脂质体对肿瘤细胞外pH值的微小变化具有敏锐的反应,肿瘤细胞的微酸性环境能够促进pH 敏感脂质体释放药物。 pH敏感脂质体能够在血液循环中保持稳定,到达肿瘤部位后释放药物从而发挥治疗作用,有效改善药物在体内的药代动力学。
常用于制作pH敏感型脂质体的材料有可质子化脂质-磷脂酰乙醇胺(PE)、棕榈酰高半胱氨酸(PHC)、二油酰磷脂酰乙醇胺(DOPE)、胆固醇琥珀酸单酯(CHEMS)及引入酸敏感键-腙键、亚胺键、酰胺键、原酯酸键或苯硼酸酯键等。
3.3 GSH还原性脂质体
氧化还原敏感型脂质体具备高生物相容性等优势,通常被用于提高脂质体的肿瘤靶向效率。利用正常组织、肿瘤部位以及细胞内外的氧化还原环境的不同,构筑具有氧化还原敏感性的药物纳米载体。
谷胱甘肽是细胞中的主要还原剂,用于维持细胞生长和功能所必需的氧化还原的稳态,被认为是细胞中硫醇与二硫化物相互转化时的氧化还原缓冲液。但是,肿瘤的生长往往需要特定的环境以及各种营养物质,所以在肿瘤区域内谷胱甘肽的含量比正常组织高100倍。这种极端的浓度差造成了氧化还原环境的不同,二硫键和二硒键等氧化还原敏感化学键可在这种刺激下响应性断裂,使载体降解发生释药,继而使谷胱甘肽成为药物递送中的氧化还原反应触发剂。利用含有氧化还原敏感键的材料制备脂质体是引入氧化还原敏感键最常用的方法之一。
3.4 温度敏感型脂质体
作为一种重要的药物传递系统,热敏型脂质体已经在医学领域广泛运用。它们具有温度响应性和药物释放的精确控制能力,可通过对肿瘤组织的局部加热,使其在目标区域释放药物,提高药物在肿瘤组织的富集能力。
3.5 光敏型脂质体
光敏型脂质体属于环境响应型功能性脂质体,可以实现光敏剂在肿瘤部位按需、可控和可触发递送,提供光动力治疗和其他肿瘤治疗方法的联合平台,增强抗肿瘤效果。当光敏型脂质体被暴露在特定波长的光下时,包封于脂质体内部或链接在外部的光敏剂会吸收光能并发生化学反应或热效应,导致脂质体结构的改变或破坏,从而释放药物。 目前,光热疗法和光动力治疗是治疗癌症最有前景的技术之一。它们具有灵活性和可调节性,可以根据不同类型的肿瘤和个体化的治疗需求进行定制。热疗法和光动力治疗还可以与其他治疗方法相结合,如化疗和放疗,以提高治疗效果并降低副作用和毒性。目前临床上常用于构建光敏型脂质体的光敏剂有卟吩姆钠、血卟啉衍生物、5-氨基酮戊酸等,通常采用掺杂进脂质体的方式建立。
3.6 磁靶向脂质体
磁敏感脂质类载体常用脂质制备Fe3O4、Fe3O4等包载磁性材料。含有稳定氧化铁颗粒的磁敏感脂质体在磁场的刺激下能够靶向并触发释放包封的药物。其原理是在外加磁场的作用下,利用磁介质中的磁热效应,使载体温度发生改变,导致载体失稳从而释放药物。通过磁场响应型脂质体靶向给药,增加肿瘤组织内药物的富集,同时实现可控释药。研究表明,当某种特定配体耦合于磁性脂质体表面时,该脂质体能够将药物精准输送到靶向部位,从而减少对邻近健康组织的毒害。2005年的一项研究将脂溶性抗癌药物多西紫杉醇包载于磁性脂质体后进行给药,发现对乳腺癌的治疗效果更为显著。

图5 磁靶向脂质体结构
4.第四代脂质体:双载药脂质体
由于肿瘤细胞的多样化,联合给药就显得尤为关键。化疗药物往往具有很高的细胞毒性,所以选取安全有效的递送载体和合理的联合给药方式成为现在癌症治疗的难关。现阶段双载药脂质体经常采取将脂溶性药物载于磷脂双分子层中,水溶性药物载于脂质体内水相中的载药方式,如下图所示。这种设计既保证了药物递送过程中不同药物之间不会发生过多的接触,产生反应变性,又有利于将不同性质的药物联合给药,降低了肿瘤药物联合应用的局限性。
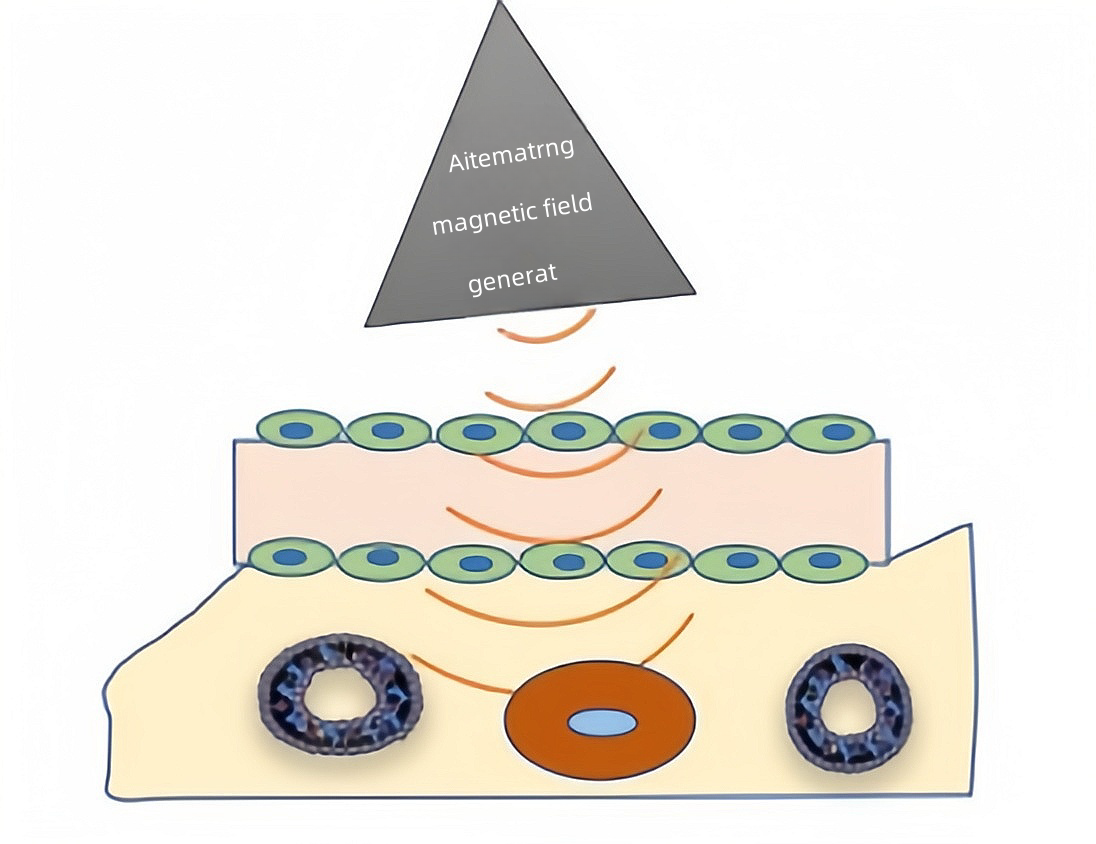
图6 双载药脂质体的结构
联合用药在脂质体抗肿瘤领域已取得不错的临床进展。加拿大Celator公司研制了3个复方脂质体伊立替康-氟尿嘧啶脂质体复方(CPX-1)、阿糖胞苷-柔红霉素脂质体复方(CPX-351)和 伊立替康-顺铂脂质体复方(CPX-571),其中CPX-1用于治疗直结肠癌,CPX-351用于治疗急性骨髓白血病(AML),CPX-571用于治疗小细胞肺癌,前两种药物均已进入临床阶段,而CPX-571正在进行临床前研究。说明复方脂质体已开始进入肿瘤临床应用。
脂质体的发展势态良好,且已取得了不小的成就, 目前已有多种脂质体上市,且有数量较多的脂质体制剂参与临床前与临床阶段研究。表2中列出了目前上市或临床阶段的部分具有代表的脂质体。
| 分类 | 商品名 | 研发单位 | 获批时间 | 产品状态 | 适应症 | 作用机制 | |
|---|---|---|---|---|---|---|---|
| 被动靶向 | DaunoXome | NeXstar (Gilead) | 1995 (美国) | 已上市 | AIDS相关的卡波西肉瘤 | 柔红霉素具有抗有丝分裂和细胞毒活性,抑制拓扑异构酶II活性,抑制 DNA 聚合酶活性。采用主动载药法将柔红霉素包裹于脂质体中增加了药物在实体瘤部位的蓄积,延长了药物作用时间,并且降低了心脏毒性 | |
| 长循环 | 里葆多 | 复旦张江生物医药股份有限公司 | 2009 (中国) | 已上市 | 乳腺癌、卵巢癌、 淋巴瘤、多发性骨髓瘤、白血病等多种癌症 | 阿霉素也属于蒽环类抗肿瘤药物,主要进入肿瘤细胞细胞核,通过抑制 DNA的合成,进而抑制细胞分裂。PEG 化脂质体阿霉素能定向识别肿瘤位置,延长药物半衰期。 | |
| 主动靶向 | 抗体靶向 | MCC-465 | 日本国立癌症研究所 | — | 临床Ⅰ/Ⅱ | 转移性或复发性胃癌 | MCC-465是包裹阿霉素的免疫脂质体。脂质体用聚乙二醇和F(ab’)2的单克隆抗体标记,GAH标记的脂质体能被广泛内化,而GAH未标记的脂质体不能 |
| 环境敏感型 | 热敏 | ThermoDox | Celsion 公司 | — | 临床Ⅰ | 肝癌 | 负载抗癌药物多柔比星的热敏脂质体ThermoDox可以运用射频消融术(radiofrequencyablation ,RFA)在 40~42℃迅速释放绝大多数药物。和微波热疗技术相结合,其热敏脂质体技术可以成功的应用于临床 |
| 脂质体共同递送两种或两种以上作用靶点不同的化药物 | Vyxeos | 爵士制药 | 2017-8-23 (美国) | 已上市 | 相关性急性髓系白血病(t-AML)和伴骨髓增生异 常相关改变的急性髓细胞白血病 (AML-MRC) | 阿糖胞苷是细胞周期阶段特异性抗肿瘤剂,通过抑制 DNA聚合酶起作用。与单独接受柔红霉素+阿糖胞苷两种药物治疗相比,Vyxeos可增加协同作用,减少拮抗作用,显着提高化疗效果,延长患者的生存时间 | |
文章信息源于文献:《脂质体在抗肿瘤研究中的发展》,登载该文章目的为更广泛的传递行业信息,不代表赞同其观点或其真实性负责。文章版权归原作者及原出处所有,文章内容仅供参考。本网拥有对此声明的最终解释权,若侵犯版权,请联系小编删除。

