用于胶质母细胞瘤靶向 siRNA 递送和 CRISPR-Cas 基因编辑的聚合物锁定融合脂质体

胶质母细胞瘤(GBM) 是最致命的中枢神经系统癌症,部分原因是未能对抗治疗耐药性。GBM 中 midkine(MDK) 的上调加速了化疗药物(如替莫唑胺(TMZ))引起的 DNA 损伤的修复。尽管 RNA 干扰(RNAi) 和 CRISPR-Cas9(CRISPR(成簇规则间隔短回文重复序列))基因编辑技术是有吸引力的方法,但它们的实施具有挑战性。这是因为以活性形式静脉内(i.v.)递送短干扰 RNA (siRNA) 或 CRISPR-Cas9 核糖核蛋白(RNP)复合物涉及一个复杂的三步过程。生物制品必须(i)进入目标细胞,通常通过内吞作用;(ii)从内溶酶体逃逸进入细胞质;以及(iii)从其载体中释放。在步骤(ii)中,生物制品从内溶酶体逃逸通常很低。此外,几个生理障碍,特别是血脑屏障(BBB),仍然需要克服以实现脑内递送。
研究人员证明了聚合物锁定融合脂质体(表示为 Plofsomes),它可以跨 BBB 运输并将 siRNA 和 CRISPR-Cas9 RNP 复合物递送到 GBM 细胞的细胞质中。通过使用无痕修饰方法将四臂聚乙二醇-邻位二酚 (4-arm PEG-oDP) 锚定到 Angiopep-2(Ang)修饰的融合脂质体的表面上来制备 Plofsome。由于 GBM 组织中的 ROS 水平高,因此选择了无痕活性氧 (ROS) 可切割接头元。Ang 是低密度脂蛋白受体相关蛋白1(LRP-1) 的特异性配体,在 BBB 内皮细胞和 GBM 细胞中高度表达。研究人员选择融合脂质体作为核心结构,因为它们具有出色的胞质递送性能。具体来说,药物内化和释放同时发生,简化了给药过程。此外,由融合脂质体递送的药物绕过内溶酶体途径,从而防止溶酶体降解。然而,融合脂质体在脑靶向药物递送方面存在严重缺陷。它们通过与脑内皮细胞融合来穿过 BBB,这会导致脂质体在进入大脑之前解体。在这种情况下,虽然生物制剂被输送到大脑,但它们通常以裸露状态存在,导致细胞内化效率低下。为了解决这个问题,研究人员将“锁”整合到融合脂质体上,以便仅在穿过 BBB 并进入 GBM 组织后发生融合。4-arm PEG-oDP作为锁,通过修饰Ang修饰的融合脂质体表面来获得Plofsome。Plofsomes在血液循环中以及在穿越BBB期间保持非融合状态。进入大脑后,Plofsomes被肿瘤组织中过表达的ROS(过氧化氢)刺激,导致4-arm PEG-oDP脱落,使Plofsomes变得具有融合性。类似于只有在解锁时才能打开的保险箱,Plofsomes仅与目标细胞融合,并在高过氧化氢水平的环境中释放其有效载荷。MDK被选为治疗靶点。研究结果表明,Plofsomes有效地将siMDK或CRISPR-Cas9 RNP复合物递送至GBM细胞质中。结果,通过Plofsome配方抑制MDK减少了TMZ抵抗性,并抑制了原位脑肿瘤模型中的GBM生长。
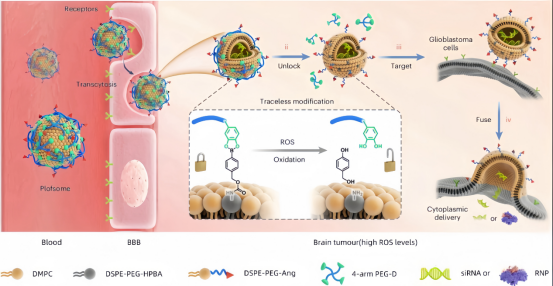
图1:Plofsomes用于GBM靶向siRNA递送和CRISPR-Cas基因编辑。
MDK 促进 TMZ 耐药和 GBM 细胞的进展
首先对患者来源的组织进行了单细胞 RNA 测序 (scRNA-seq), 并通过细胞标志物注释癌细胞。与其他细胞类型相比,GBM 细胞中的 MDK 表达显着升高。免疫组化(IHC)进一步证实了这一点,显示WHO 4级GBM组织中MDK表达更高,导致肿瘤恶性程度增加。通过分析不同数据集,研究人员确定了31个与TMZ耐药性和GBM恶性进展相关的基因,其中MDK表达上调与患者生存率下降显著相关。实验结果显示,TMZ治疗对TMZ耐药的GBM细胞形成的肿瘤无效,且这些肿瘤组织中MDK表达增加。
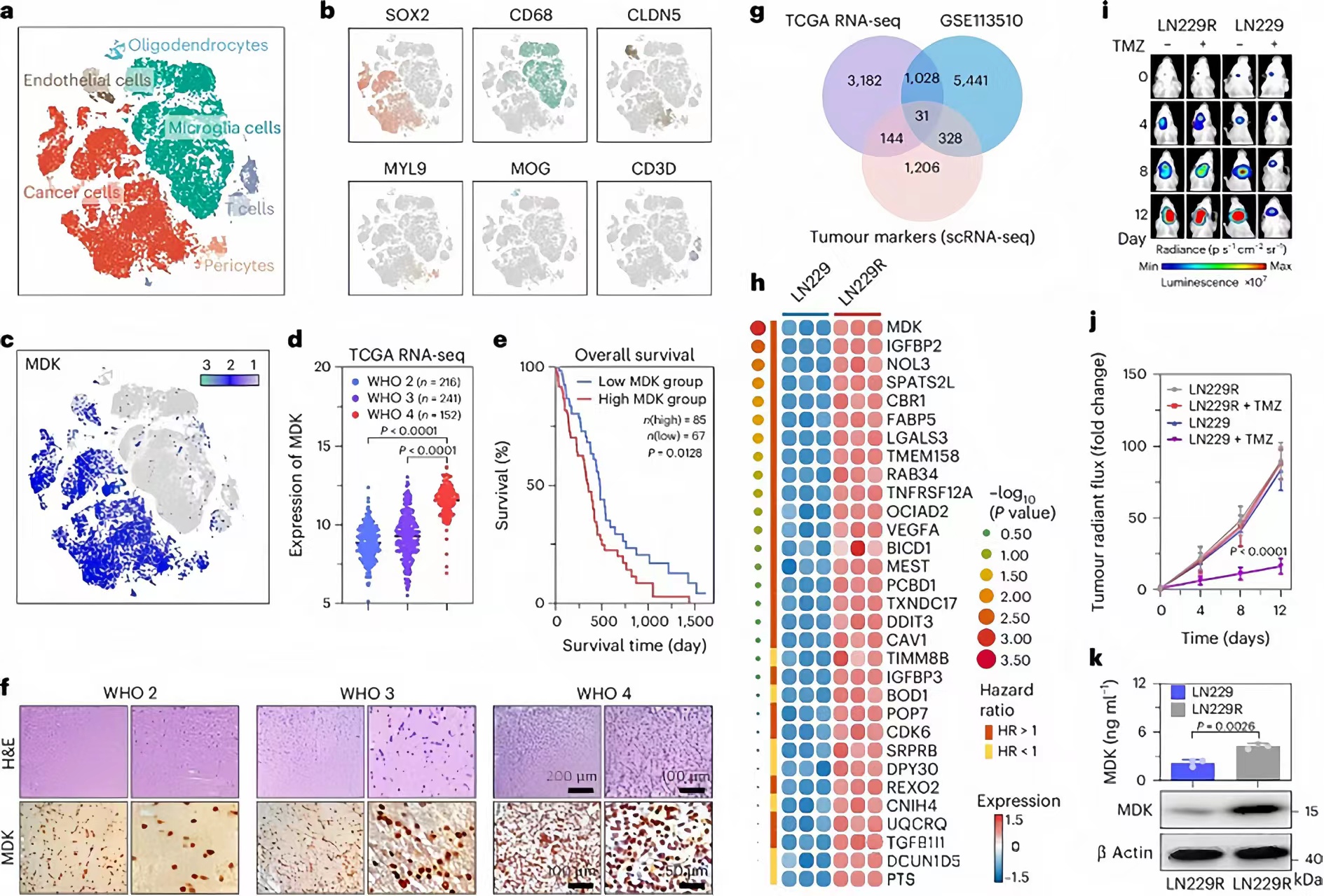
图 2:MDK 促进 TMZ 耐药和GBM 细胞的恶性进展。
Plofsomes 的制备和表征
研究人员成功制备了一种新型融合脂质体Plofsomes,通过将4-(羟甲基)苯基硼酸(HPBA)和4臂聚乙二醇-邻二酚(4-arm PEG-oDP)进行可触发降解修饰,实现了表面涂层。Plofsomes的粒径约为120 nm,Plofsomes 的 zeta 电位为 +6.1 ± 0.7 mV,Plofsomes 的透射电子显微镜 (TEM) 图像显示,它们具有具有双层结构的封闭囊泡形态。在H2O2刺激下,Plofsomes的HPBA部分发生氧化和水解,导致4-arm PEG-oDP脱落,从而触发脂质体的不稳定性并恢复其融合性。通过FRET实验,研究人员观察到4-arm PEG-oDP的存在调节了脂质体的脂质分子侧向流动性,影响其结构稳定性。这种设计使Plofsomes在GBM组织中因高ROS水平而表现出与血液中不同的特性,有助于提高药物递送效率。
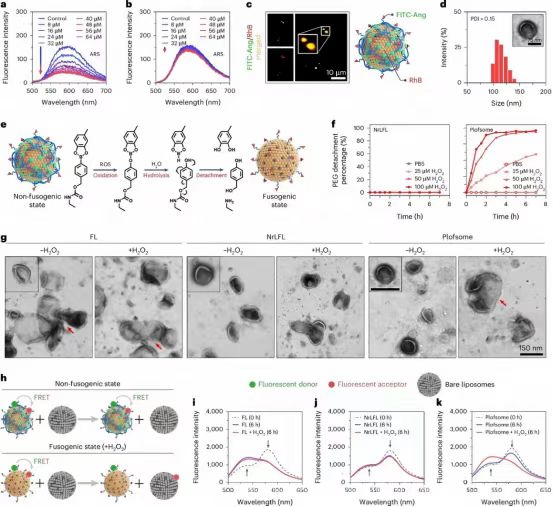
图 3:Plofsomes 的表征
使用 Plofsome 将 siRNA 递送到 GBM 细胞细胞质中
接下来,研究人员研究了Plofsomes与GBM细胞融合的能力,发现在H2O2存在下,Plofsomes能与GBM细胞融合,而没有H2O2时则主要定位于细胞内溶酶体。通过共聚焦激光扫描显微镜(CLSM)观察,证实了Plofsomes在H2O2处理后能将siRNA释放到细胞质中。此外,Plofsomes展现出良好的生物相容性,并通过膜融合而非内吞作用进入细胞。在体外BBB模型中,Plofsomes能有效穿越BBB,并在模拟的ROS环境中与GBM细胞融合,释放siRNA。相比之下,未加H2O2处理的Plofsomes主要通过内吞作用进入细胞。实验结果表明,Plofsomes在H2O2刺激下能够特异性地与GBM细胞融合并释放其内容物,而未处理的Plofsomes则保持稳定。
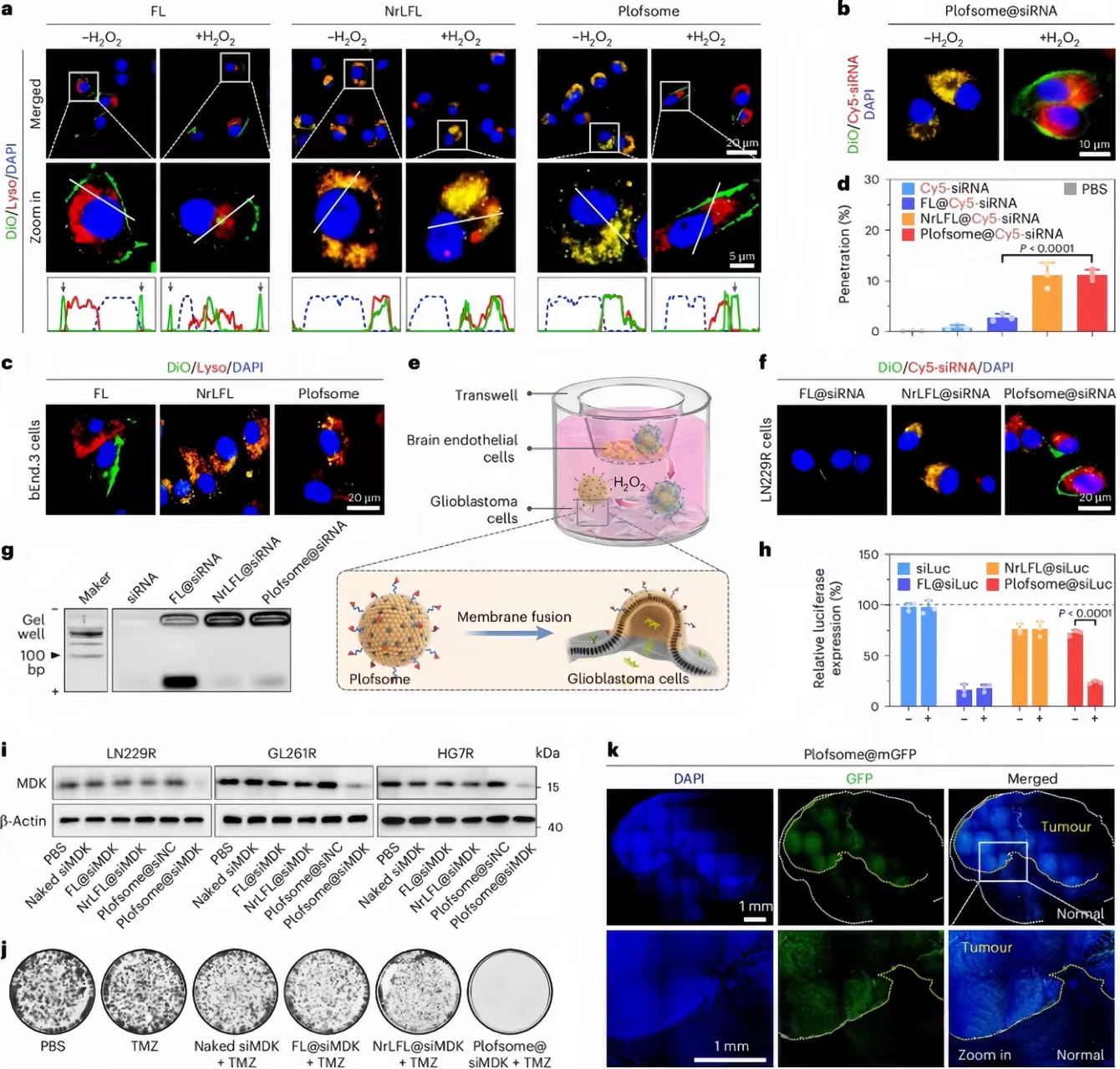
图 4:Plofsomes 在接受 H2O2时与质膜融合刺激并将 siRNA 递送到细胞质中。
使用 Plofsome@siMDK 抑制 MDK 抑制 GBM 生长
紧接着,研究人员利用表达荧光素酶(Luc)的LN229R细胞测试了Plofsomes对基因沉默的效果,发现在H2O2存在下,Plofsome@siLuc能显著降低Luc表达,其效率与FL@siLuc相当。进一步研究发现,Plofsome@siMDK能在H2O2存在时有效降低MDK表达,并通过EdU实验和集落形成实验证实了其抗肿瘤活性。在体外BBB模型中,Plofsome@siMDK能有效降低GBM细胞中的MDK表达,而FL@siMDK则效果不佳。此外,Plofsome@siMDK处理减少了LN229R细胞的增殖,且在bEnd.3细胞中未引起明显的MDK沉默,显示出良好的安全性。
GBM 靶向 Plofsome@siMDK 及其抗肿瘤活性
研究人员建立LN229R肿瘤裸鼠模型,发现Plofsome@Cy5-siRNA能高效穿越BBB,且在肿瘤组织中表达更高。Plofsome@siMDK能有效沉默MDK基因,与TMZ联合使用时,显著抑制了GBM肿瘤的生长,并且提高了小鼠的生存率。Plofsome@siMDK的治疗效果优于单独使用TMZ或与其他siMDK配方联合使用。此外,Plofsome@siMDK在抑制肿瘤细胞增殖和DNA损伤修复方面也表现出色,且其基因沉默特异性高,不影响正常组织。
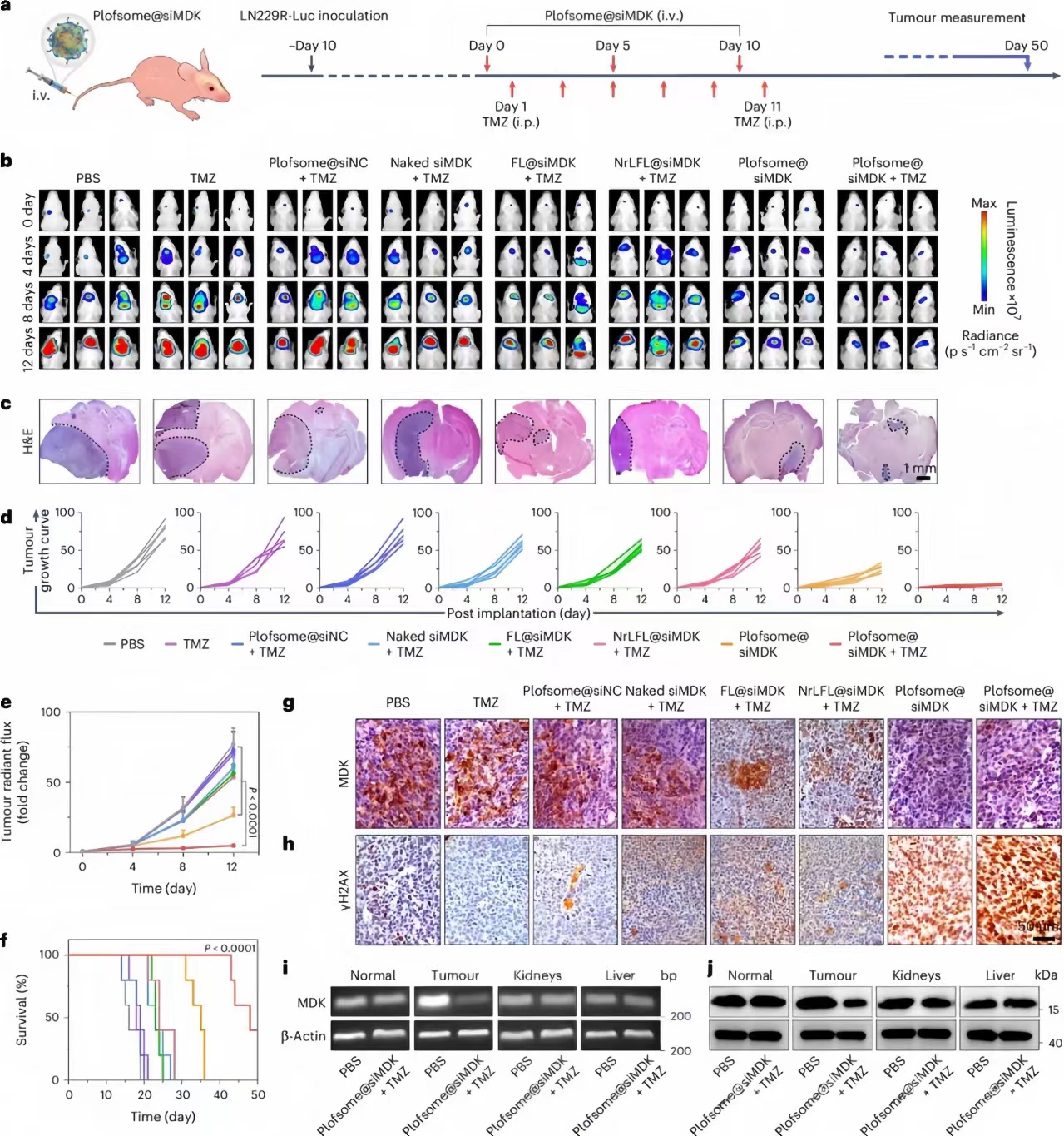
图 5:Plofsome@siRNA 在原位 LN229R-Luc 荷瘤小鼠模型中的抗肿瘤疗效。
结论:
研究人员开发了一种Plofsome,可以穿过血脑屏障,将siRNA和CRISPR-Cas9-RNP复合物递送到GBM细胞的细胞质中。具体来说,研究人员使用可触发降解的ROS可切割接头将4-arm PEG-oDP整合到脑靶向融合脂质体中,以构建Plofsomes。Plofsome在血液循环和BBB跨越过程中都保持非融合状态。进入大脑后,Plofsome受到GBM组织中过表达的ROS的刺激,从而分离出4-arm PEG-oDP并变得融合。这种设计确保了只有在进入GBM组织后才能进行靶向融合和货物释放。MDK基因促进TMZ抗性。研究结果表明,Plofsomes有效地将siMDK和CRISPR-Cas9-RNP复合物递送到GBM细胞的细胞质中。在原位脑肿瘤模型中,有效的MDK抑制导致TMZ耐药性和GBM生长抑制显著降低。至关重要的是,Plofsomes仅在ROS水平较高的肿瘤部位有效,而在正常脑组织中无效,这增强了RNAi或CRISPR-Cas9联合治疗对TMZ耐药性的安全性。
原文链接;https://www.nature.com/articles/s41565-024-01769-0

